Опубликовано в журнале:
Современная онкология »» 2010, № 3, Т.12 Возможности химиотерапии рака молочной железы, резистентного к антрациклинам и таксанам
Н.С.Бесова, В.А. Горбунова
ГУ Российский онкологический научный центр им. Н.Н.Блохина РАМН, МоскваНесмотря на постоянное расширение спектра эффективных цитостатиков, проблема лечения резистентного к химиотерапии (XT) метастатического рака молочной железы (мРМЖ) остается по-прежнему актуальной.
Выявление метастазов на различных этапах развития злокачественного процесса наблюдается у 30-80% больных раком молочной железы (РМЖ) [1]. Внедрение в клиническую практику последнего десятилетия новых противоопухолевых препаратов привело к достоверному улучшению отдаленных результатов лечения, однако медиана продолжительности жизни больных мРМЖ пока еще колеблется в пределах 2-3 лет, а 5-летняя выживаемость составляет 26,7% [2].
Основные достижения таргетной терапии связаны с трастузумабом, кардинально изменившим прогноз больных HER2-позитивным РМЖ. Амплификация гена HER2/neu при РМЖ встречается приблизительно в 25% случаев и требует отдельного рассмотрения. Вопросов лечения данной подгруппы пациенток мы не будем касаться.
Наиболее активными при РМЖ препаратами, обладающими различным механизмом противоопухолевого действия, являются антрациклины и таксаны. Антрациклины связывают ДНК топоизомеразу II, включая и аденозинтрифосфатзависимый способ расхождения нитей ДНК, в результате чего происходит формирование реактивных кислородных соединений. Таксаны обратимо связывают (β-тубулин, стабилизируя таким образом гуанозиндифосфат - связанную форму (β-тубулина, что приводит к блоку деполимеризации и стимуляции полимеризации тубулина из-за отсутствия гуанозинтрифосфата. Результатом действия препаратов является остановка клеточного роста и индукция апоптоза [1].
Комбинации, включающие антрациклины и таксаны, широко применяются в 1 -й линии терапии мРМЖ и при операбельных формах в качестве адъювантной и неоадъювантной XT. Повторное или длительное назначение этих препаратов зачастую приводит к формированию опухолевой резистентности к ним.
Клинически резистентность к антрациклинам и таксанам определяется как прогрессирование болезни (ПБ) в течение 6-12 мес после окончания нео- или адъювантной XT, а также как ПБ, зарегистрированное на фоне XT или в течение 3 мес после введения последней дозы цитостатиков по поводу мРМЖ [3,4].
Механизмы развития резистентности опухоли к антрациклинам и таксанам включают гиперэкспрессию транспортных белков, удаляющих цитостатик из опухолевой клетки, мутации генов, гиперэкспрессию β-III-тубулина или изменения, связанные с сигнальными белками [5, 6]. В основе механизма развития резистентности к антрациклинам лежит повышенная экспрессия транспортных белков, осуществляющих выведение препарата из опухолевой клетки, таких как Р-170 гликопротеин (P-gp) и белок множественной лекарственной резистентности 1 (MRP1). Следствием гиперэкспрессии этих белков является усиленный выброс цитостатиков из клетки. Этот же механизм вовлекается и в процесс формирования резистентности к таксанам. Другим механизмом развития резистентности к таксанам является повышение экспрессии белка β-III -тубулина (изотипа β -тубулина III класса), аффинитет к которому у ингибиторов микротубулина значительно снижен [7].
В случаях приобретенной резистентности опухоль может стать резистентной не только к использованным препаратам, но и к широкому спектру цитостатиков с различным механизмом действия. Вероятность достижения значительного эффекта от дальнейшей XT в подобных случаях прогрессивно снижается, а вероятность развития тяжелых, вплоть до жизнеугрожающих, побочных эффектов возрастает [8].
Целью лекарственной терапии мРМЖ является максимальный контроль опухолевых симптомов и предупреждение осложнений, связанных с опухолью, а также максимально возможное увеличение продолжительности и улучшение качества жизни больных путем оптимальной XT и минимальной ее токсичности [9]. При выборе оптимального режима лекарственной терапии учитываются как характеристики пациентки: возраст, сопутствующие заболевания, менопаузальный статус, общий функциональный статус, персональные предпочтения, так и характеристики заболевания: локализация и распространенность метастатического процесса; гормональный (и HER2/neu) статус опухоли; характер предшествующей терапии, ее эффективность и переносимость; длительность безрецидивного/беспрогрессивного периода [10].
Нерешенной проблемой XT резистентного мРМЖ является вопрос о целесообразности использования комбинаций противоопухолевых агентов по сравнению с их последовательным назначением в монорежиме.
В настоящее время I.Park опубликовал результаты исследования, в котором проведено сравнение эффективности комбинации гемцитабина с винорельбином (n=42) и их последовательного назначения (n=40) во 2-3-й линии лечения мРМЖ [11]. Достоверных различий в терапевтической эффективности и токсичности не получено.
При развитии резистентности к антрациклинам, как правило, назначаются таксаны, если они не использовались ранее: доцетаксел, паклитаксел, абраксан. При назначении паклитаксела предпочтение отдается еженедельному режиму введения как более эффективному и менее токсичному по сравнению со стандартным введением 1 раз в 3 нед.
При дальнейшем прогрессировании процесса после таксанов возможно применение капецитабина, гемцитабина, пегилированного липосомального доксорубицина, винорельбина, хотя их эффективность в данном случае крайне низка (табл. 1).
Оптимизм в этой ситуации вселяют результаты исследования нового класса противоопухолевых препаратов - эпотилонов, наиболее ярким представителем которого является иксабепилон.Эпотилоны получены путем естественной ферментации миксобактерии Sorangiumcellulosum. Основными компонентами являются эпотилоны А и В. Механизм противоопухолевого действия эпотилонов аналогичен такса-новому: связывание с β -тубулином микротрубочек, блокада их деполимеризации и стимуляция полимеризации, что приводит к стабилизации микротубулярного аппарата, остановке митоза в фазе G2/M с последующим апоптозом опухолевых клеток.
Иксабепилон (BMS-247550, aza-epothilone В) является первым полусинтетическим аналогом эпотилона В. Несмотря на сходный механизм действия, иксабепилон обладает рядом преимуществ перед таксанами вследствие отличия в химической и пространственной структуре молекулы. Благодаря структурным особенностям иксабепилон сохраняет активность при мутациях β -тубулина в местах его связывания с паклитакселом, подавляет динамическую нестабильность β -III-тубулина, сохраняя активность при его экспрессии, не индуцирует гиперэкспрессию P-gp и MRP1, практически не вступает во взаимодействие с ними. Как показано на экспериментальных моделях РМЖ, иксабипелон сохраняет противоопухолевую активность в отношении клеточных линий и перевиваемых опухолей, резистентных к XT антрациклинами, таксанами, капецитабином [18, 19].
Таблица 1. Рандомизированные контролируемые исследования III фазы по изучению эффективности XT мРМЖ после лечения антрациклинами и/илитаксанами
Примечание. N - число предшествующих режимов XT по поводу мРМЖ; n - число больных; МВДП - медиана времени до прогрессирования болезни (ВДП - временной интервал от момента рандомизации пациентки до момента объективной констатации ПБ, но не смерти больной). МВБП - медиана выживаемости без ПБ (ВВП - временной интервал от момента рандомизации пациентки до момента объективной констатации прогрессирования болезни или смерти больной); MOB - медиана общей выживаемости; ПЛД - пегилированный липосомальный доксорубицин; АХТ - адъювантная XT; НеоАХТ - неоадъювантная XT; р/д - раз в день; д - дней; 95% ДИ - 95% доверительный интервал.
АвторРезистентность к
N
Режим, дозы в мг/м2
n
МВДП/МВБП
HR[95% ДИ]
MOB
HR[95% ДИ]
S.Jones, 2005 [12]
Антрациклинам
≤1
Доцетаксел 100/21 д
Паклитаксел 175/21 д225
2247,5 мес
3,6 мес1,64 [1,33-2,02]
р<0,000115,4 мес
12,7 мес1,41 [1,15-1,73]
р=0,03W.Gradishar, 2005 [13]
Антрациклинам
0-3
Наб-Паклитаксел 260/21 д
Паклитаксел 175/21 д229
22523 нед
16,9 нед0,75
р=0,0665 нед
55,7 недр=0,374
K.AIbain, 2008 [14]
АХТ или НеоАХТ
0
Паклитаксел 175 в 1 д + Гемцитабин 1250 в 1 и 8 д/21 д
Паклитаксел 175/21 д266
2636,1 мес
4,0 мес0,70 [0,59-0,85]
р=0,000218,6 мес
15,8 мес0,82 [0,67-1,00]
р=0,489A.Keller, 2004 [15]
Таксанам(n=301)
Антрациклинам (n=112)1 или 2
ПЛД 50/28 д
Митомицин 10 в 1 д + Винбластин 5 в 1 д/21 д или винорельбин 30/нед150
1512,9 мес
2,5 мес1,26[0,98-1,62]
р=0,1110,4 мес
9,0 мес1,07 [0,79-1,45]
р=0,57M.Martin, 2007 [16]
Таксанам и антрациклинам
≤2
Гемцитабин1200 + Винорельбин 30 в 1 и 8 д/21 д
Винорельбин 30 в 1 и 8 д/21 д125
1266,0 мес
4,0 мес0,66 [0,50-0,88]
р=0,002815,9 мес
16,4 мес1,04 [0,78-1,39]
р=0,8046K.Miller, 2005 [17]
Таксанам
Антрациклинам1 или 2
Бевацизумаб 15 мг/кг в 1 д + Капецитабин1250 2р/д в 1-14 д/21 д
Капецитабин1250 2р/д в 1-14 д/21 д232
2304,86 мес
4,17 мес0,98[0,77-1,25]
р=0,85715,1 мес
14,5 меср>0,05
По результатам клинических исследований I фазы, для дальнейшего изучения были рекомендованы 2 режима введения иксабепилона: 3-часовая инфузия в дозе 40 мг/м2 каждые 3 нед и 1-часовая инфузия в дозе 6 мг/м2 1 раз в день на протяжении пяти последовательных дней каждые 3 нед.
Данные клинических исследований II фазы по оценке эффективности иксабепилона при резистентном мРМЖ представлены в табл. 2. Применение иксабепилона после антрациклинов позволило получить объективный эффект (ОЭ) у 42-58% больных при MOB и МВБП 22 и 4,8-5,5 мес соответственно. При резистентности к таксанам ОЭ составил 12-22%, МВБП - 2,2-2,6 мес, MOB - 7,9 мес. Большинство больных получали иксабепилон в режиме 40 мг/м2 каждые 3 нед.
Таблица 2. Эффективность иксабепилона во 2-й и 3-й линиях XT мРМЖ во II фазе исследования
АвторПредшествующая XT
n
Режим
ОЭ,%
СБ, %
МдлРем, мес.
МВБП, мес.
МОВ, мес.
Perez, 2007 [20]
Антрациклины, таксаны, капецитабин
126
40 мг/м2 3 ч каждые 3 нед
11,5
50
5,7
3,1
8,6
Thomas, 2007 [21]
Таксаны
49
40 мг/м2 3 ч каждые 3 нед
12
41
10,4
2,2
7,9
Roche, 2007 [22]
Антрациклины
65
40 мг/м2 3 ч каждые 3 нед
42
35
8,2
4,8
22
Low, 2005 [23]
Таксаны
37
6 мг/м21 ч в дни 1, 2, 3, 4. 5 каждые 3 нед
22
26
3,9
2,6
НД
Denduluri, 2007 [24]
Нет-7 больных
Любая XT -16 больных
Антрациклины (А) -12 больных23
6 мг/м21 ч в дни 1, 2, 3, 4, 5 каждые 3 нед
57 (после А 58)
26 (после А 33)
5,6
5,5
НД
Примечание. СБ - стабилизация болезни; НД – нет данных; МДлРем - медиана длительности ремиссии.
Сводные данные по профилю токсичности обоих режимов введения иксабепилона суммированы в табл. 3 [2, 5]. Нейтропения 3-4-й степени являлась преобладающим видом гематологической токсичности, чаще наблюдалась у больных, получавших иксабепилон в дозе 40 мг/м2 1 раз в 3 нед (54-58%), однако достаточно редко была фебрильной или сопровождалась инфекционными осложнениями.Таблица 3. Побочные эффекты 3-4-й степени тяжести (%) иксабепилона во 2-й и 3-й линиях XT мРМЖ во II фазе исследования
Побочный эффектИксабепилон 40 мг/м2/3 нед
240 больныхИксабепилон 6 мг/м2 5 дней/3 нед
60 больных
Анемия
Нейтропения
Фебрильная нейтропения
Тромбоцитопения
Периферическая сенсорная нейропатия
Утомляемость/астения
Миалгии/артралгии
Стоматит/мукозит
Тошнота/рвота
Изменения ногтей
Диарея
Ладонно-подошвенный синдром
Реакции гиперчувствительности
3-8
54-58
4-10
0-8
12-206-27
8-10
4-6
2-6
0
1-4
0-2
0-1
0
22-35
0-14
4-8
0-313
3-4
0
4-5
0
4-11
0
0Cреди негематологических побочных эффектов наиболее важной является периферическая нейропатия, которая, как и при таксанах, является зависимой от разовой дозы и режима введения (чаще встречается при введении иксабепилона 40 мг/м2 1 раз в 3 нед), кумулятивной и относится к дозолимитирующему виду токсичности. При введении иксабепилона в дозе 40 мг/м2 1 раз в 3 нед периферическая нейропатия развивалась в основном после проведения 4 курсов лечения, была обратимой и разрешалась в среднем через 5,4 нед. Начальные ее проявления описываются как типично сенсорные нарушения: парестезии, дизестезии в области конечностей. Однако у 3% из 240 пациенток описаны нейропатические боли 3-4-й степени, фиксированные в последующем в исследованиях III фазы. Данный вид нейропатии отличается от нейропатии, вызванной таксанами, и не связан с их предшествующим использованием.
Реакции гиперчувствительности, связанные с растворителем (Кремофором), зафиксированы менее чем у 1% больных благодаря обязательной премедикации блокато-рами H1- и Н2-рецепторов гистамина.
Данные об эффективности иксабепилона в монотерапии при мРМЖ, резистентном к антрациклинам и/или таксанам, а также экспериментальные данные о синергизме его противоопухолевой активности с капецитабином послужили основанием для проведения двух крупных клинических исследований III фазы: СА163-046 [26] и СА163-048 [27].
Оба исследования посвящены сравнению эффективности и токсичности комбинации иксабепилона с капецитабином и монотерапии капецитабином у больных мРМЖ, резистентном к антрациклинам и таксанам. После рандомизации пациенткам группы исследования назначали иксабепилон 40 мг/м2 в виде 3-часовой инфузии в первый день 21-дневного цикла в комбинации с приемом капецитабина в суточной дозе 2000 мг/м2, разделенной на 2 приема, с 1 по 14-й дни 21 -дневного цикла. Пациентки контрольной группы получали капецитабин в суточной дозе 2500 мг/м2, разделенной на 2 приема, с 1 по 14-й дни 21-дневного цикла. Лечение продолжали до регистрации ПБ или признаков непереносимой токсичности. Для профилактики реакций непереносимости перед введением иксабепилона назначали премедикацию антагонистами H1- и Н2-рецепторов гистамина. Оценка эффективности лечения осуществлялась каждые 6 нед. вплоть до ПБ. Назначение комбинации после регистрации ПБ на фоне монотерапии не разрешалось.
Резистентность к антрациклинам определялась как ПБ на фоне лечения или в первые 3 мес после введения последней дозы по поводу мРМЖ, или рецидив болезни в первые 6 мес после окончания адъювантной или неоадъювантной XT.Критерием резистентности к таксанам являлось ПБ на фоне XT или в первые 4 мес. после введения последней дозы по поводу мРМЖ, или рецидив заболевания в первые 12 мес после окончания адъювантной или неоадъювантной XT.
Основным являлось исследование СА163-046, главной целью которого была сравнительная оценка выживаемости без ПБ, определяемая как время от момента рандомизациибольной до регистрации ПБ или смерти от любой причины. Дополнительными параметрами изучения являлись частота достижения объективного эффекта, выживаемость больных, переносимость лечения. В исследование включали только пациенток с измеряемыми проявлениями заболевания. Динамику болезни на фоне лечения оценивали как сами исследователи, так и независимые эксперты.
Исследование СА163-048 было организовано с целью подтверждения результатов СА163-046. Главной его целью была сравнительная оценка общей выживаемости больных, дополнительно оценивались также частота достижения объективного эффекта, выживаемость без прогрессирования болезни, переносимость лечения. В исследование включали пациенток, получивших ранее антрациклины и таксаны, имевших как измеряемые, так и неизмеряемые проявления болезни. Оценку эффективности XT проводили сами исследователи.
Характеристика больных, включенных в исследования, и предшествующей XT представлена в табл. 4.Таблица 4. Характеристика больных, включенных в два исследования III фазы по сравнительному изучению комбинации иксабепилона с капецитабином и капецитабина в монорежиме
Параметр
Основное исследование (СА163-046)
Подтверждающее исследование (СА163-048)
иксабепилон + капецитабин (n=375)
капецитабин (n=377)
иксабепилон + капецитабин (n=609)
rапецитабин (n=612)
Медиана возраста, лет (диапазон)
53 (25-76)
52 (25-79)
53 (23-78)
53(24-81)
Индекс Карновского, %
70-80
90-100
32
67
36
63
33
67
26
74Число предшествующих режимов XT, %
0
1
2
>3
7
48
41
5
9
49
37
6
20
61
18
<1
19
63
17
<1Характеристика предшествующей терапии таксанами, %
Резистентность к таксанам
98
96
49
53
Первичная резистентность к таксанам
40
36
18
19
Висцеральные метастазы (печень и/или легкие)
84
84
66
67
Гормонопозитивный РМЖ
46
47
56
54
Гормононегативный РМЖ
44
43
37
41
Трижды негативный рак
24
26
20
22
По данным обоих исследований медиана выживаемости без прогрессирования болезни оказалась достоверно выше при использовании комбинированного режима по сравнению с монотерапией капецитабином (табл. 5): соответственно 5,3 мес против 3,8 мес в исследовании СА163-046 и 6,2 мес против 4,4 мес в исследовании СА163-048. Комбинация иксабепилона с капецитабином позволила в 2-3 раза увеличить продолжительность контроля опухолевого роста при трижды негативном мРМЖ.
Таблица 5. Результаты исследования III фазы иксабепилона: выживаемость без прогрессирования (по оценке исследователей)
Основное исследование СА163-046
Подтверждающее исследование СА163-048
иксабепилон +
капецитабин (n =375)капецитабин
(n =377)иксабепилон +
капецитабин (n =480)капецитабин
(n =480)МВБП, мес [95% ДИ]
HR[95%ДИ]
p
Трижды негативный мРМЖ
n
МВБП, мес [95% ДИ]
HR[95%ДИ]
p5,3 [4,27-5,59]
0,78(0,67-0,91]
0,001191
4,1
0,68
0,00033,8(2,86-4,17]
0,79 [0,69-0,90]
0,000596
2,1
0,64 [0,48-0,84]6,2 [5,59-6,67]
100
4,24 [3,45-5,49]4,4 [4,14-5,42]
1,8 [1,5-2,92]
Оценка независимых экспертов в исследовании СА163-046 совпадала с данными исследователей: комбинация капецитабина с иксабепилоном привела к увеличению медианы выживаемости больных без признаков прогрессирования процесса с 4,2 мес (95% ДИ 3,81-4,5) до 5,8 мес (95% ДИ 5,45-6,97), что соответствует повышению данного показателя на 40%.
Таким образом, в основном исследовании комбинация иксабепилона с капецитабином превзошла по эффективности монотерапию капецитабином по главному параметру оценки - выживаемости без прогрессирования (HR, 0,75; 95% ДИ 0,64-0,88; стратифицированный log-rank p=0,0003), снизив риск прогрессирования болезни на 25% (см. рисунок).
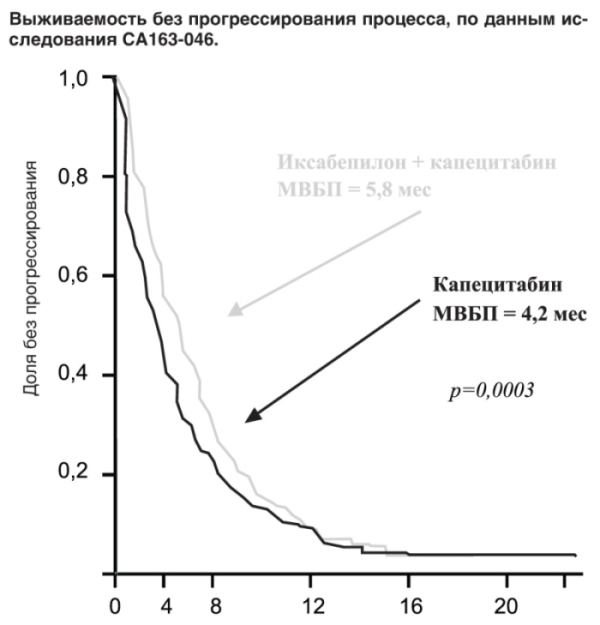
Объективный эффект также достоверно чаще регистрировали при использовании комбинированного режима, чем при монотерапии капецитабином (табл. 6).
Таблица 6. Результаты исследования III фазы иксабепилона: эффективность (в %) по данным исследователей
Основное исследование СА163-046
Подтверждающее исследование СА163-048
иксабепилон + капецитабин (п=375)
капецитабин (п=377)
иксабепилон + капецитабин (п=482)
капецитабин (п=482)
ОЭ [95% ДИ]
ПР
ЧР
СБ42,1 [37,1-47,3]
3
39
3622,5[18,4-27,1]
1
22
3843,3 [38,7-47,9]
3
40
3728,8 [24,7-33,2]
2
26
39Примечание. ОЭ - объективный эффект; ПР - полная регрессия опухоли; ЧР - частичная регрессия опухоли; СБ - стабилизация болезни.
Согласно оценке независимых экспертов в исследовании СА163-046 применение иксабепилона в комбинации с капецитабином по сравнению с монотерапией капецитабином позволило повысить частоту достижения объективного эффекта с 14 до 35% (р<0,0001). Частота объективного эффекта при первичной резистентности к таксанам также была выше у больных, получавших комбинированную XT: 33% против 14%.
Медиана длительности ремиссии в основном исследовании составила 6,4 мес. при комбинированной XT и 5,6 мес. при монотерапии. Время до регистрации объективного эффекта было практически одинаковым: 11,7 нед. и 12 нед. соответственно.
В исследовании СА163-046 был проведен анализ таких параметров эффективности лечения, как частота достижения объективного эффекта и выживаемость без прогрессирования болезни в соответствии с различным рецепторным статусом РМЖ и последующий сравнительный анализ полученных данных с аналогичными параметрами для всей группы в целом. Результаты подгруппового анализа совпали с результатами сравнительного анализа эффективности у всей группы пациенток: частота объективного эффекта и медиана выживаемости были достоверно выше при комбинированной XT (табл. 7).
Таблица 7. Исследование СА163-046. Результаты анализа эффективности лечения всей группы больных и подгрупп с различным рецепторным статусом
Параметр
Подгруппы больных мРМЖ с различным рецепторным статусом
все больные
ТНРМЖ
неТНРМЖ
ЭР+
ЭР-
икса + кап
кап
икса + кап
кап
икса + кап
кап
икса + кап
кап
икса + кап
кап
Число больных
ОЭ, %
МВБП, мес375
35 (р<0,0001)
5,8 (р=0,0003)377
14
4,291
27
4,196
9
2,1284
37
7,1281
16
5,0
173
40
7,6178
19
5,7202
30
4,4199
10
2,8HR[95% ДИ]
0,75 [0,64-0,93]
0,68 [0,50-0,93]
0,74 [0,61-0,88]
0,81[0,64-1,03]
0,65 [0,52-0,80]
Примечание. ТНРМЖ - трижды негативный рак молочной железы; ЭР+ - эстроген-рецепторопозитивный РМЖ; ЭР- - эстроген-рецепторонегативный РМЖ; икса - иксабепилон; кап - капецитабин.
Комбинация иксабепилона с капецитабином по сравнению с монотерапией капецитабином позволила повысить эффективность лечения пациенток, страдающих наименее благоприятной формой заболевания - трижды негативным РМЖ, резистентном к таксанам и антрациклинам, увеличить частоту достижения объективного эффекта с 9 до 27% и МВБП с 2,1 до 4,1 мес. [28]. Эффективность комбинированного режима не зависела от гормонорецепторного статуса опухоли и была выше монотерапии как при гормонорецепторопозитивном, так и при гормонорецепторонегативном мРМЖ [29].
Сравнительная оценка общей выживаемости являлась главной целью исследования СА163-048. К сожалению, достоверных различий в общей выживаемости пациенток контрольной группы и группы исследования не получено. Однако подгрупповой анализ показал достоверное увеличение общей продолжительности жизни больных резистентным мРМЖ при наличии симптомов опухоли, т.е. при функциональном статусе 70-80% по шкале Карновского (табл. 8).
Таблица 8. Результаты исследования III фазы иксабепилона: общая выживаемость
Основное исследование СА163-046
Подтверждающее исследование СА163-048
иксабепилон + капецитабин (n=375)
капецитабин (n=377)
иксабепилон + капецитабин (n=609)
капецитабин (n=612)
MOB, мес [95% ДИ]
HR[95%ДИ]
Log-rank p12,9 [11,5-14,2]
0,9[0,77-1,05]
0,193611,1 [10,0-12,5]
0,9 [0,78-1,03]
0,116216,4 [14,9-17,9]
15,6[13,9-17,0]
Общая выживаемость больных, имеющих симптомы опухоли (состояние по шкале Карновского 70-80%)
MOB, мес [95% ДИ]
HR[95%ДИ]
Log-rank p10,05[7,56-12,16]
0,75[0,58-0,98]
0,03287,79 [5,78-9,36]
0,76[0,60-0,96]
0,018914,03[11,60-15,64]
11,33[9,13-13,63]
Побочные явления химиотерапии, зафиксированные в исследованиях, в большинстве своем относились к 1-2-й степени тяжести и были в основном обратимыми. Побочные эффекты 3-4-й степени тяжести суммированы в табл. 9 и 10.
Таблица 9. Результаты исследования III фазы иксабепилона: гематологическая токсичность 3-4-й степени тяжести (% больных) [27]
Показатель
Основное исследование СА163-046
Подтверждающее исследование СА163-048
иксабепилон+ капецитабин (n=366)
капецитабин (n=364)
иксабепилон + капецитабин (n=595)
Капецитабин (n=603)
Медиана количества циклов, проведенных одной больной
Нейтропения
Лейкопения
Анемия
Тромбоцитопения
Фебрильная нейтропатия5
68
57
10
8
44
11
6
4
4
16
73
63
5
6
45
8
7
4
3
2Таблица 10. Результаты исследования III фазы иксабепилона: негематологическая токсичность 3-4-й степени тяжести (% больных) [27]
Показатель
Основное исследование СА163-046
Подтверждающее исследование СА163-048
иксабепилон +капецитабин (n=369)
капецитабин (n=368)
иксабепилон + капецитабин (n=482)
капецитабин (n=482)
Медиана количества циклов, проведенных одной больной
5
4
6
5
Периферическая нейропатия
23
0
24
1
Медиана времени разрешения неиропатии*, нед (диапазон)
6,0 (4,6-7,6)
Не выявлена
6,2 (5,0-8,7)
Не выявлена
Ладонно-подошвенный синдром
18
17
21
20
Утомляемость
9
3
12
3
Диарея
6
9
7
9
Миалгия
8
<1
5
0
Смерть вследствие токсичности
3
<1
<1
<1
Артралгии
3
0
3
0
Стоматит
1
1
2
1
* Период времени с момента регистрации максимальной степени неиропатии до ее полной регрессии или снижения до 1-й степени
Наиболее частым видом гематологической токсичности комбинированного режима была нейтропения. Нейтропения 3-4-й степени, зафиксированная у 68-73% пациенток, имела характер фебрильной только у 4% (см. табл. 9). Поддержка колониестимулирующими факторами была назначена 20% больных, получавших комбинацию, и 3% пациенток контрольной группы.
Анемия и тромбоцитопения встречались нечасто в обеих группах, тяжесть их в основном не превышала 2-й степени.
Наиболее частыми видами негематологической токсичности 3-4-й степени тяжести при комбинированной XT являлись периферическая сенсорная нейропатия, ладонно-подошвенный синдром, утомляемость, миалгия, астения и диарея (см. табл. 10). В группе монотерапии капецитабином в ряду побочных явлений 3—4-й степени тяжести лидировали ладонно-подошвенный синдром и диарея, которые фиксировались с той же частотой, что и при комбинированном режиме.Периферическая нейропатия, характерная для комбинированного режима, была по преимуществу сенсорной, легкой и умеренной степени тяжести, кумулятивной и в основном обратимой. Сенсорная нейропатия 4-й степени тяжести была зарегистрирована у 1% больных. Периферическая нейропатия явилась причиной прекращения введения одного или обоих препаратов у 21% больных в среднем после 6 курсов комбинированной XT. В большинстве случаев XT была продолжена с введением иксабепилона в редуцированной дозе. После редукции дозы по поводу персистирующей нейропатии 2-3-й степени пациентки получали в среднем еще 3 (от 1 до 16) курса лечения. Полное разрешение нейропатии 3-4-й степени или снижение ее тяжести до 1-й степени наступало в среднем через 6,0 нед.
В целом токсичность послужила причиной прекращения лечения у 18% больных, получавших комбинированный режим, и у 7% пациенток в группе капецитабина.
Таким образом, в исследованиях II фазы показана эффективность иксабепилона при мРМЖ, резистентном к антрациклинам, таксанам и капецитабину. В двух крупных рандомизированных исследованиях III фазы доказано и подтверждено, что комбинация иксабепилона с капецитабином при мРМЖ, резистентном к таксанам и антрациклинам, превосходит по частоте объективного эффекта и продолжительности контроля опухолевого роста капецитабин в монорежиме. При этом выигрыш в эффективности достигается как при эстрогенрецепторопозитивных, так и при эстрогенрецепторонегативных опухолях.
При наличии симптомов, связанных с опухолевым процессом, иксабепилон в комбинации с капецитабином достоверно увеличивает выживаемость без прогрессирования и общую продолжительность жизни больных резистентным мРМЖ.
Согласно результатам подгруппового анализа иксабепилон в комбинации с капецитабином достоверно эффективнее капецитабина при наименее благоприятном подтипе мРМЖ - трижды негативном.Иксабепилон в монорежиме и в комбинации с капецитабином обладает умеренной и обратимой токсичностью. Наиболее частыми побочными явлениями 3-4-й степени тяжести являются нейтропения, которая редко сопровождается фебрильными осложнениями, и кумулятивная сенсорная периферическая нейропатия. Оба вида токсичности обратимы и поддаются коррекции путем редукции дозы.
Статья написана при поддержке компании «Bristol Myers Squibb».
На основании данных клинических исследований II и III фазы Food and Drug Administration (FDA), США, рекомендовал иксабепилон в комбинации с капецитабином для лечения больных мРМЖ, резистентном или рефрактерном к антрациклинам и таксанам, а также в монорежиме - при мРМЖ, резистентном к антрациклинам, таксанам и капецитабину.
ЛИТЕРАТУРА
- Castaneda CA, Gomez HL. Prolonged Disease Control in a Patient With Anthracycline- and Taxane-Resistant Breast Cancer. Clinical Breast Cancer 2009; 9 (4):B1-E3.
- SEER Cancer Statistics Review, 1975-2006. . AccessedJune 2 0 09.
- Thomas E, Tabernero J., Former M. et al. Phase II clinical trial ofixabepilone (BMS-247550), an epothilone B analogue,in patients with taxaneresistant metastaticbreastcancer. J. Clin. Oncol. 2007; 25:3399-406.
- Pivot X., Asmar I., Buzdar A.U. et al. A unified definition ofclinical anthracycline resistance breast cancer. BrJ Cancer 2000; 82:529-34.
- Longley D.B., Johnston P.G. Molecular mechanisms of drug resistance. J. Pathol 2005; 205: 275-92.
- Chien A.J., Moasser M.M. Cellular mechanisms of resistance to anthracyclines and taxanes in cancer: Intrinsic and acquired. Semin Oncol 2008; 35(Suppl.2):Sl-14.
- Gradishar W. Management of advanced breast cancer with the epothilone В analog, Ixabepilone. DrugDes Devel Ther 2009; 3:163-71.
- Moreno-Aspitia A., Perez E.A. Anthracycline- and/or Taxane-Resistant Breast Cancer: Results of a Literature Review to Determine the Clinical Challenges and Current Treatment Trends. Clin. Ther. 2009; 31 (8).
- Mayer E.L., Burstein H.J. Chemotherapy for metastatic breast cancer. Hematol. Oncol. Clin. North. Am. 2007; 21:257-72.
- National Comprehensive Cancer Network. NCCNPractice Guidelines in Oncology 2009; 1. Breast Cancer http://www.nccn.org/clinical.asp. Accessed January 2009.
- Park l. Het al. Invest. New drugs 2009.
- Jones S.E.,Erban J., Overmoyer В. et al. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer. J. Clin. Oncol. 2005; 23:5542-51.
- Gradishar W.J., Tjulandin S., Davidson N. et al. Phase III trial ofnanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer. J. Clin. Oncol. 2005; 23: 7794-803.
- Albain K.S., Nag S.M., Calderillo-Ruiz G. et al. Gemcitabine plus paclitaxel versus paclitaxel monotherapy in patients with metastatic breast cancer and prior anthracycline treatment. J. Clin. Oncol. 2008; 26: 3950-7.
- Keller A.M., Mennel R.G., Georgoulias V.A. et al. Randomized phase III trial of pegylated liposomal doxorubicin versus vinorelbine or mitomydn С plus vinblastine in women with taxane-refractory advanced breast cancer. J. Clin. Oncol. 2004; 22:3893-901.
- Martin M., Ruiz A., Munoz Met. al. Gemcitabine plus vinorelbine versus vinorelbine monotherapy in patients with metastatic breast cancer previously treated with anthracyclines and taxanes: final results of the phase III Spanish breast cancer research group (GEICAM) trial. Lancet Oncol. 2007; 8: 219-25.
- Miller K.D., Chap L.I., Holmes F.A. et al. Randomized phase HI trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol 2005; 23: 792-9.
- Lee F.Y.F., Camuso A., Castenada S. et al. Preclinical studies ofixabepilone (BMS-247550) demonstrate optimal antitumor activity against both
chemotherapy-sensitive and -resistant tumor types. Proc. Am. Assoc. Cancer Res. 2006; 47: 119, (abstr 503).
- Wartmann M., Altmann K.H. The biology and medicinal chemistry of epothilones. Curr. Med. Chem. Anticancer Agents 2002; 2:123-48.
- Perez E.A., Lerzo G., Pivot X. et al. Efficacy and safety of ixabepilone (BMS-247550) in a phase II study of patients with advanced breast cancer resistant to an anthracycline, a taxane, and capecitabine. J Clin Oncol 2007; 25:3407-14.
- Thomas E., Tabernero J., Fomier M. et al. Phase II clinical trial of ixabepilone (BMS-247550), an epothilone B analogue, in patients with taxane-resistant metastatic breast cancer. J. Clin. Oncol. 2007; 25:3399-406.
- Roche H., Yelle L., Cognetti F. et al. Phase II clinical trial of ixabepilone (BMS-247550), an epothilone B analogue, as first-line therapy in patients with metastatic breast cancer previously treated with anthracycline chemotherapy. Clin Oncol 2007; 25:3415-20.
- Low J.A., Wedam S.B., Lee J.J. et al. Phase II clinical trial of ixabepilone (BMS-247550), an epothilone B analogue, in metastatic and locally advanced breast cancer. J. Clin. Oncol. 2005; 23:2726-34.
- Denduluri N., Low J.A., Lee J.J. et al. Phase II trial of ixabepilone, an epothilone B analogue, in patients with metastatic breast cancer previously untreated with taxanes. J. Clin. Oncol. 2007; 25:3421-7.
- Pivot X., Villanueva C., Chaigneau L. et al. Ixabepilone < a novel epothilone analog in treatment of breast cancer. Expert Opin Investig Drugs2008; 17 (4): 593-9-
- Thomas E.S., Gomez H.L., Li R.K. et al. Ixabepilone plus capecitabine for metastatic breast cancer progressing after anthracycline and taxane treatment. J. Clin. Oncol. 2007;25:5210-7.
- Hortobagyi G.N., Perez E., Vdoljak E. et al. Analysis of overall survival amongpatienys with metastatic breast cancer receiving either ixabepilone plus capecitabine or capecitabine alone and review of results from
two randomized phase III trials. ASCO Breast 2008 (Абстракт 186).
- Rugo H., Thomas E.S., Lee R.K. et al. Combination therapy with ixabepilone plus capecitabine is effective in ER/PR/HER2-negative breast cancer resistant to antracyclines and taxanes. Presented at 30th Annual San Antonio Breast Cancer Symposium. December 13-16, 2007.
- Pivot X., Li R.K.,Thomas E.S. et al. Phase 3 study of ixabepilone plus capecitabine in patients with metastatic breast cancer resistant to antracyclines/ taxanes: subgroup analysis by estrogen receptor status. Reported at the Breast Cancer Symposium. September 8,2007- San Francisco, C.A.
| Май 2012 г. |