|
ГАСТРОЭНТЕРОЛОГИЯ
ГЛАВА 42. ОПУХОЛИ ТОНКОЙ КИШКИ 1. Как часто встречаются опухоли тонкой кишки? Новообразования тонкой кишки
встречаются относительно редко, что само по себе достаточно удивительно,
поскольку длина тонкой кишки в среднем составляет приблизительно 6 м, т.
е. 75 % длины всего желудочно-кишечного тракта, а площадь поверхности слизистой
оболочки тонкой кишки составляет 90 % от площади поверхности слизистой
оболочки всего желудочно-кишечного тракта. На долю опухолей тонкой кишки
приходится только 1-2 % всех опухолей желудочно-кишечного тракта. Из всех
опухолей тонкой кишки, которые обнаруживаются на аутопсии, 75 % являются
доброкачественными, тогда как 75 % опухолей, которые сопровождались различными
клиническими симптомами и выявлялись на операции, оказываются злокачественными.
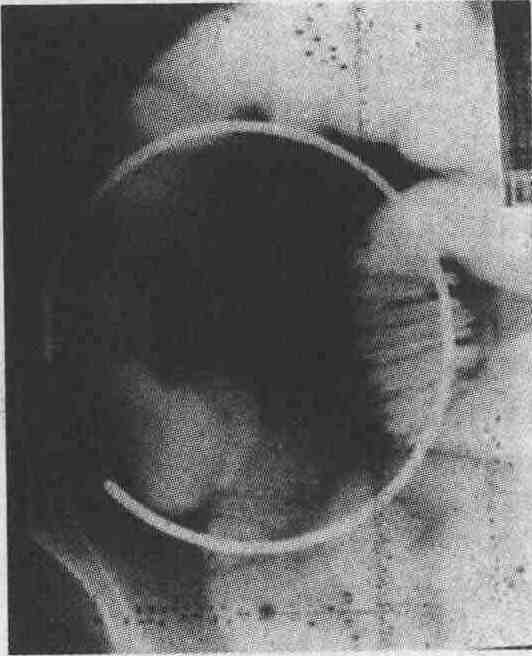
При рентгенографии с бариевой взвесью на снимке обнаружено полиповидное образование в подвздошной кишке. Позже было установлено, что это — карциноидная опухоль 2. Какие злокачественные опухоли чаще всего встречаются в тонкой кишке? Наиболее часто встречающиеся злокачественные опухоли тонкой кишки и их анатомическая локализация
3. При каких заболеваниях имеется повышенный риск развития аденокарциномы тонкой кишки? При наличии у пациентов аденоматозного
полипоза толстой кишки, который наблюдается при семейном полипозе и
синдроме Гарднера, у них существует повышенный риск развития аденокарциномы
тонкой кишки. Чаще всего при этом аденокарцино-ма локализуется в двенадцатиперстной
кишке, преимущественно в периампулярном отделе. Риск развития аденокарциномы
тонкой кишки при этом заболевании оценивается как 1 случай на 1700 человек
в год. Таким пациентам рекомендуется периодически проводить эндоскопические
осмотры органов желудочно-кишечного тракта с использованием приборов как
с прямой, так и с боковой оптикой. При обнаружении любой патологии в периампулярной
области и полипов двенадцатиперстной кишки необходимо выполнять биопсию.
При повышении концентрации щелочной фосфа-тазы в крови и обнаружении какой-либо
патологии в периампулярной области необходимо выполнять эндоскопическую
ретроградную холангиопанкреатографию (ЭРХПГ). Кроме того, показанием к
эндоскопическому обследованию служит первичное обнаружение аденоматозных
полипов.
4. Какие полипы в тонкой кишке преобладают у пациентов с бессимптомным течением семейного аденоматозного полипоза? При семейном аденоматозном полипозе в 90 % случаев полипы обнаруживаются в двенадцатиперстной кишке. Они локализуются преимущественно во второй части (в нисходящей ветви) двенадцатиперстной кишки в виде скоплений в периампулярном отделе. В Японии при обследовании пациентов с бессимптомным течением семейного аденоматозного полипоза у 50 % из них в области большого сосочка двенадцатиперстной кишки были обнаружены аденомы. Эндоскопически у большинства из этих пациентов большой дуоденальный сосочек имел гранулярный или узловатый вид, однако в 14 % случаев аденоматозная ткань обнаруживалась и в нормальном на вид сосочке. При обследовании белых американцев с семейным аденоматозным полипозом в 50 % случаев в области большого сосочка двенадцатиперстной кишки выявлены аденомы, и в 22 % аденоматозная ткань выявлена в нормально выглядящих сосочках. 5. Какие существуют два типа лимфом тонкой кишки и чем они отличаются? Существует два типа первичных
лимфом тонкой кишки: иммунопролиферативная лимфома (ИПЛ), которая также
носит название средиземноморской лимфомы, и не-иммунопролиферативная лимфома
(неИПЛ), которая также известна под названием западной лимфомы.
6. Опишите морфологическую картину тонкой кишки при иммунопролиферативной лимфоме. На ранних стадиях заболевания или в так называемую "прелимфоматозную фазу" длинный участок проксимального отдела тонкой кишки диффузно инфильтрирован лимфоцитами и плазматическими клетками. Стенка кишки становится плотная и отечная, слизистая оболочка утолщенная и гранулированная. В начале развития заболевания слизистая оболочка выстлана цилиндрическими клетками и щеточная кайма остается интактной. По мере нарастания инфильтрации энтероциты становятся более плоскими и появляются мелкие изъязвления слизистой оболочки. При дальнейшем прогрессировании процесса образуются опухолевые узлы, состоящие преимущественно из незрелых плазмоцитов и лимфоцитов. Эти узлы поражают мышечный слой слизистой оболочки, но иногда распространяются и на всю толщину кишечной стенки. На более поздних стадиях заболевания стенка кишки утолщается либо в некоторых местах, либо диффузно, образуются стриктуры, дилатация кишки и крупные опухолевые массы. Брыжеечные лимфатические узлы изменяются параллельно с поражением кишки. В запущенных случаях опухоль может метастазировать в соседние органы, реже в селезенку, печень и внебрюшные лимфатические узлы. У 20-90 % пациентов с иммунопролиферативной лимфомой в сыворотке крови обнаруживается а-протеин, хотя приблизительно в 50 % случаев обычный электрофорез сыворотки крови является недостаточно чувствительным для его обнаружения. 7. Существуют ли какие-либо патогномоничные для иммунопролиферативной лимфомы симптомы? Для большинства пациентов с иммунопролиферативной лимфомой характерны хронические боли в животе и диарея, которая в начальных стадиях заболевания может быть интермиттирующей. При прогрессировании заболевания первичная водянистая диарея может переходить в ярко выраженную стеаторею. У 50-75 % пациентов с иммунопролиферативной лимфой пальцы на руках и ногах принимают форму барабанных палочек. На более поздних стадиях заболевания у половины пациентов возникает лихорадка. 8. Как следует лечить пациентов с иммунопролиферативной лимфомой? Достигнуть ремиссии на ранних стадиях заболевания у большинства пациентов с иммунопролиферативной лимфомой удается при приеме тетрациклина, кортикостероидных гормонов, циклофосфамида или комбинации этих препаратов. На более поздних стадиях заболевания эффективны лучевая терапия и комбинированная химиотерапия циклофосфамидом, винкристином, преднизолоном с или без доксорубицина. Ремиссия может продолжаться месяцы или годы, однако прогноз все-таки остается плохим. Пятилетняя выживаемость среди 97 обследованных больных составила 22,7 %. 9. Каковы факторы риска развития лимфомы тонкой кишки? Этиология неиммунопролиферативной
лимфомы в настоящее время пока не известна. Риск развития лимфомы выше
у пациентов с врожденным или приобретенным иммунодефицитом, включая пациентов
со СПИД ом, с трансплантированными органами, после химиотерапии по поводу
злокачественных новообразований, с синдромом Вискотта-Олдрича (Wiskott-Aldrich)
и т. д. Также риск развития лимфомы велик у пациентов, подвергшихся ионизирующему
излучению, и у больных с системными васкулитами и коллагенозами (заболевания
соединительной ткани). Было описано несколько случаев развития лимфомы
у пациентов с болезнью Крона, но какие-либо выводы делать из этого пока
еще рано. Не было описано ни одного случая развития лимфомы кишечной или
внекишечной локализации у пациентов с неспецифическим язвенным колитом.
10. Опишите характерные симптомы карциноидных опухолей тонкой кишки. Наиболее характерными клиническими проявлениями карциноида тонкой кишки являются эпизодические боли в животе, перемежающиеся с симптомами интермиттиру-ющей кишечной непроходимости. Среди 183 обследованных пациентов с карциноидом тонкой кишки продолжительность заболевания до установления диагноза в среднем составляет 2 года. Длится заболевание до 20 лет. В связи с локализацией опухоли глубоко в стенке кишки и небольшими ее размерами инвагинация при карциноиде тонкой кишки возникает достаточно редко и не превышает 3 %. Опухоль стимулирует развитие фибробластической реакции в брыжейке пораженной кишки, вследствие чего длина брыжеечного края кишки уменьшается и кишка как бы сворачивается в петлю. Этим и объясняется возникновение кишечной непроходимости, причину которой практически невозможно установить при контрастной рентгенографии. Если опухоль метастази-рует в брыжеечные и чревные лимфатические узлы, они могут сдавливать сосуды, что может привести к ишемии и некрозу кишки. Карциноидные опухоли даже при массивном метастатическом поражении печени могут протекать практически бессимптомно. 11. Каковы причины системных клинических проявлений карциноидных опухолей? Системные проявления карциноидных
опухолей известны под общим названием карциноидного синдрома. Развитие
карциноидного синдрома обусловлено тем, что опухолевые клетки первичного
карциноида тонкой кишки распространяются с током крови по всему организму.
Достаточно часто карциноидный синдром развивается у пациентов с метастатическим
поражением печени. Важно отметить, что для клинического развития карциноидного
синдрома необходимо наличие в организме большого количества опухолевой
ткани. Признаком развития карциноидного синдрома является резкая гиперемия
кожи при эмоциональном стрессе, во время приема пищи, алкоголя или полового
сношения. К другим симптомам карциноидного синдрома относятся диарея, астма,
пеллагра и на более поздних стадиях заболевания так называемое карциноидное
поражение сердца. Приступы карциноидной астмы происходят достаточно редко,
а пеллагра появляется уже в терминальной стадии заболевания на фоне кахексии.
Диарея является самым частым симптомом при карциноидном синдроме. Однако
она может быть обусловлена не только собственно карциноидным синдромом,
но и различными механическими факторами, такими как частичная кишечная
непроходимость или выполненная ранее резекция большого участка кишки.
12. Как необходимо обследовать пациентов с подозрением на наличие карциноидного синдрома? Если у пациента есть признаки
карциноидного синдрома (приливы, диарея, астма и так далее) необходимо
собрать суточную мочу для определения содержания 5-ГИУК. У 75 % пациентов
с карциноидным синдромом количество 5-ГИУК в суточной моче составляет более
800 ммоль/л. Ложноположительный результат может быть спровоцирован избыточным
приемом некоторых пищевых продуктов, таких как бананы, ананасы, помидоры,
авокадо, грецкие орехи, орехи пекан и серые орехи. Также ложнопо-ложительный
результат может быть вызван приемом гваифенезина или ацетомино-фена, тогда
как ложноотрицательный результат может быть обусловлен приемом ле-водопы
или аспирина. У некоторых пациентов с карциноидом могут быть классические
клинические проявления карциноидного синдрома при сохранении нормальной
концентрации 5-ГИУК в моче. В этих случаях необходимо определять содержание
серотонина в плазме крови и тромбоцитах.
13. Какие существуют способы консервативного лечения карциноида? Консервативная терапия карциноида
направлена на уменьшение массы опухоли и подавление клинических симптомов,
хотя заболевание при этом медленно прогрессирует. Некоторые пациенты с
обширным метастатическим процессом могут нормально жить в течение многих
лет. Раньше для борьбы с проявлениями карциноидного синдрома применяли,
и практически безуспешно, очень большое количество лекарств, таких как
клонидин, феноксибензамин, пропранолол, фентоламин, фенфлюрамин, альфа-метилдопа
и метилдопа. Сейчас для борьбы с диареей с успехом используется ципрогептадин,
но он редко уменьшает приливы и совсем не снижает выделение 5-ГИУК с мочой.
Ципрогептадин назначают в дозе 4-8 мг в день. При применении октреотида,
аналога соматостатина, диарея обычно прекращается в течение нескольких
часов, а приливы — в течение нескольких минут. Концентрация серотонина
в плазме крови и экскреция 5-ГИУК с мочой при этом также резко снижаются.
При лечении октреотидом у 90 % пациентов более чем на 50 % уменьшаются
приливы, а концентрация 5-ГИУК в моче снижается у 2/3
пациентов более чем на 50 %. У некоторых пациентов может наступить истинная
регрессия опухоли. К сожалению, лечебный эффект аналогов соматостатина
непродолжителен, у большинства пациентов рецидив заболевания возникает
приблизительно через год. Причины такого непродолжительного действия этих
препаратов пока не известны. Начальная доза октреотида составляет 150 мг
три раза в день. При незначительном эффекте препарата дозу его можно увеличивать.
Побочные эффекты октреотида минимальны, но при высоких его дозировках может
развиться стеаторея. Хроническая терапия октреотидом может привести к развитию
желчнокаменной болезни вследствие застоя желчи у Уз пациентов. Учитывая
высокую стоимость октреотида и возможность развития устойчивости к его
приему, октреотид следует использовать в качестве препарата резерва для
пациентов с тяжелым заболеванием, потерей трудоспособности и значительным
ухудшением качества жизни.
14. Что такое карциноидный криз? Состояние, которое известно под названием карциноидного криза, характеризуется интенсивными генерализованными приливами, сохраняющимися в течение часов и дней, нарушениями со стороны ЦНС вплоть до потери сознания и комы, сердечнососудистыми нарушениями, включающими аритмии, гипертензию и гипотензию. Карциноидный криз обычно развивается в результате воздействия стрессовых реакций, например при введении в наркоз или проведении химиотерапии. Спасти жизнь пациенту в таких ситуациях можно с помощью октреотида. 15. Какие существуют хирургические методы лечения карциноида? Карциноид тонкой кишки редко обнаруживается до тех пор, пока не возникают боли в животе или не развивается кишечная непроходимость. К эндоскопическому удалению таких опухолей прибегают редко, чаще всего используют оперативное лечение. Предоперационная подготовка кишки не так важна при операции на тонкой кишке, как при вмешательстве на толстой. У пациентов с кишечной непроходимостью подготовку кишки перед операцией проводить вовсе не следует. Методом выбора при этом является сегментарная резекция тонкой кишки, хотя, если опухоль локализуется в проксимальном отделе двенадцатиперстной кишки или распространяется на поджелудочную железу, может понадобиться выполнение панкреатодуоденальной резекции Уиппла. Во время операции необходимо также удалять регионарные лимфатические узлы в области первичной опухоли. При поражении подвздошной кишки может возникнуть необходимость в гемиколэктомии, но при этом следует сохранить, по возможности, больший участок подвздошной кишки, с тем чтобы избежать развития в послеоперационном периоде диареи и недостаточности витамина В12. При наличии неоперабельной опухоли для восстановления проходимости кишки и обеспечения возможности нормального питания необходимо наложить обходной межкишечный анастомоз. Во время операции надо стремиться удалить как можно больше опухолевой ткани. Для пре- и послеоперационной декомпрессии желудка используют только назогастральный зонд, необходимость в проведении назоинтестинальной интубации возникает редко. 16. Каковы характерные признаки карциноидной опухоли при проведении эндоскопического ультразвукового сканирований? Опухоли, локализующиеся субэпителиально,
очень трудно бывает обнаружить с помощью эндоскопии и рентгеноскопии. В
таких случаях для выявления опухоли внутри стенки кишки и установления
степени ее инвазии в сосуды и соседние органы используют эндоскопическое
ультразвуковое сканирование (ЭУС). При локализации опухоли внутри стенки
кишки исследование эхографической структуры слоев кишечной стенки помогает
точно определить ее локализацию.
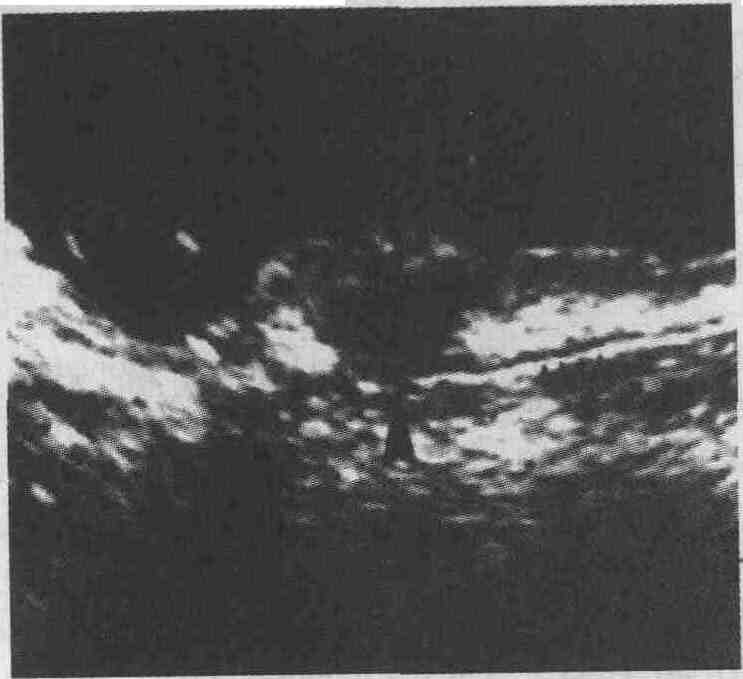
Эндоскопическое ультразвуковое сканирование карциноидной опухоли. Большая стрелка указывает на гипоэхогенную опухоль с четкими границами, маленькие стрелки — на собственную мышечную оболочку стенки кишки 17. Опишите характерные признаки саркомы тонкой кишки. Саркома представляет собой злокачественную опухоль, которая развивается из клеток мезодермальной природы. Лейомиосаркома является наиболее часто встречающимся типом сарком, поражающих тонкую кишку. Обычно лейомиосаркома возникает в возрасте 50-70 лет, у мужчин встречается несколько чаще, чем у женщин. Клинически лейомиосаркома тонкой кишки обычно проявляется болями в животе, снижением массы тела, тошнотой, рвотой. В 9 % случаев возникает перфорация кишки. Поскольку лейомиосаркомы, как правило, представляют собой опухоли достаточно большого размера, они могут вызывать кишечную непроходимость или заворот кишки. Ангиосаркома тонкой кишки может приводить к возникновению тяжелого кровотечения из сосудов опухоли. Более чем у половины пациентов лейомиосаркома при пальпации выявляется в виде опухолевидного образования в животе или в малом тазу. При компьютерной томографии часто можно обнаружить крупную опухоль с центральным некрозом. Лимфогенные метастазы лейомиосаркомы встречаются редко, опухоль обычно распространяется путем прямой инвазии или гематогенно в печень и легкие. Лечение лейомиосаркомы главным образом хирургическое, 5-летняя выживаемость при этом составляет 20-50 %. В случаях неоперабельных опухолей или при наличии отдаленных метастазов используют сочетание химиотерапии и лучевой терапии. Реакция на такое лечение наблюдается приблизительно у 50 % пациентов. 18. Какие опухоли чаще всего метастазируют в тонкую кишку? Злокачественная меланома
метастазирует в тонкую кишку наиболее часто. У 35,6-58 % пациентов меланома
обнаруживается на аутопсии и только у 8 % — при жизни. Метастазы меланомы
в тонкую кишку обычно бывают множественными, в виде диффузной инфильтрации
стенки кишки, внутрипросветных опухолей или интрамурального поражения.
Метастатические опухоли тонкой кишки могут приводить к возникновению инвагинации,
кишечной непроходимости или кровотечению. У 1/3 пациентов первичную опухоль
обнаружить так и не удается, у многих она может быть удалена многими годами
раньше.
|